2.2อนุภาคในอะตอมและไอโซโทป
อนุภาคในอะตอม
อะตอมประกอบด้วยอนุภาคมูลฐานที่สำคัญ 3 อนุภาค ได้แก่
1.อิเล็กตรอน(electron)
2.โปรตอน(proton)
3.นิวตรอน(neutron)
อนุภาคขนาดเล็กคือโปรตอน, นิวตรอน และอิเล็กตรอน มีคุณสมบัติต่างกันดังตาราง
อนุภาค
|
สัญลักษณ์
|
ประจุ(คูลอมบ์)
|
น้ำหนัก(กิโลกรัม)
|
โปรตอน
|
p
|
+1.60x10-19
|
1.67x10-27
|
นิวตรอน
|
n
|
ไม่มีประจุ
|
1.67x10-27
|
อิเล็กตรอน
|
e-
|
-1.60x10-19
|
9.11x10-31
|
จากตาราง
 อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
จำนวนโปรตอน = จำนวนอิเล็กตรอน
 โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล"
โปรตอนกับนิวตรอนเป็นอนุภาคที่มีน้ำหนักมากเมื่อเทียบกับอิเล็กตรอน ดังนั้นมวลของอะตอมก็คือจำนวนโปรตอนรวมกับจำนวนนิวตรอน นั่นคือ "เลขมวล"
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
เราสามารถเขียนเป็นสัญลักษณ์เพื่อระบุเลขอะตอมและเลขมวลได้ดังนี้
เมื่อ A แทน เลขมวล
Z แทน เลขอะตอม
X แทน สัญลักษณ์ของธาตุ
เช่น 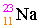
เลขอะตอม = จำนวนโปรตอน = จำนวนอิเล็กตรอน
11 = จำนวนโปรตอน = จำนวนอิเล็กตรอน
เลขมวล = จำนวนโปรตอน + จำนวนนิวตรอน
23 = 11 + จำนวนนิวตรอน
จำนวนนิวตรอน = 23 - 11 = 12
นั่นคือ ธาตุโซเดียมมีจำนวนโปรตอน, อิเล็กตรอนและนิวตรอนเท่ากับ 11, 11, 12 ตามลำดับ
ถ้าอยากทราบว่าธาตุใดมีจำนวนโปรตอน, นิวตรอนและอิเล็กตรอนเท่าใด ให้คลิกที่ธาตุนั้นได้เลย
จะเห็นได้ว่า ธาตุแต่ละธาตุมีจำนวนโปรตอน, นิวตรอนและอิเล็กตรอนต่างกันไป ทำให้แต่ละธาตุมีสมบัติทางเคมีต่างกัน
อนุภาคต่างๆ ทั้งโปรตอน นิวตรอน และอิเล็กตรอน มีขนาดเล็กมากๆ ซึ่งเล็กกว่าเส้นผ่านศูนย์กลางของเส้นผม นักวิทยาศาสตร์สามารถค้นพบอนุภาคเหล่านี้ได้อย่างไร จึงเป็นเรื่องที่น่าสนใจมาก
 อิเล็กตรอน(electron) อิเล็กตรอน(electron) |
ผู้ค้นพบ
เจ เจ ทอมสัน (J.J. Thomson)
ทำอย่างไรจึงค้นพบ
ทอมสัน ได้ทำการทดลองเกี่ยวกับการนำไฟฟ้าของแก๊สในหลอดรังสีแคโทด
วิธีทำการทดลองและผลการทดลอง หลอดรังสีแคโทด เป็นหลอดแก้วที่สูบอากาศออกหมด แล้วบรรจุแก๊สเข้าไป เมื่อให้กระแสไฟฟ้า 10,000 โวลต์ แล้ววางฉากเรืองแสงที่ฉาบด้วยซิงค์ซัลไฟต์(ZnS) ไว้ภายในหลอด จะเห็นเส้นเรืองสีเขียวพุ่งจากแคโทดไปยังแอโนด เรียกรังสีนี้ว่า "รังสีแคโทด"
เพื่อความมั่นใจว่ารังสีนั้นพุ่งจากแคโทดไปยังแอโนดจริง เขาจึงดัดแปลงหลอดรังสีแคโทดใหม่ ทำให้เขาเห็นรังสีพุ่งเป็นเส้นตรงมาจากแคโทดไปกระทบกับฉากเรืองแสง
เขาทำการทดลองต่อไป เพื่อทดสอบสมบัติของรังสีนี้ โดยเพิ่มขั้วไฟฟ้า 2 ขั้วเพื่อทำให้เกิดสนามไฟฟ้า พบว่ารังสีเบี่ยงเบนเข้าหาขั้วบวก เขาจึงสรุปว่ารังสีแคโทดประกอบด้วยอนุภาคที่มีประจุลบ
นอกจากนี้ เขาได้ทดลองให้รังสีแคโทดอยู่ในสนามแม่เหล็ก ปรากฎว่ารังสีเบนไปอีกทิศทางหนึ่งซึ่งตรงกันข้ามกับรังสีแคโทดที่อยู่ในสนามไฟฟ้า
จะได้ว่า เมื่อรังสีแคโทดอยู่ในสนามไฟฟ้าหรือสนามแม่เหล็ก รังสีจะเบนไปจากแนวเดิม โดยรังสีจะวิ่งไปหาขั้วบวกของสนามไฟฟ้า ส่วนสนามแม่เหล็กนั้นรังสีวิ่งไปหาขั้วใต้ ดังนั้นเขาจึงผ่านสนามไฟฟ้าหรือสนามแม่เหล็กไปยังรังสีแคโทด แล้วใช้อีกสนามหนึ่งมาทำให้รังสีเบนกลับเป็นเส้นตรงเหมือนเดิม แรงผลักของไฟฟ้าจะบอกว่ามีกี่ประจุ ส่วนแรงผลักจากสนามแม่เหล็กนั้นจะบอกว่าอนุภาคมีน้ำหนักเท่าใด เขาจึงหาอัตราส่วนประจุต่อมวลของอิเล็กตรอนได้
สรุปผลการทดลอง
 อิเล็กตรอนเป็นองค์ประกอบร่วมที่พบในธาตุใดก็ได้ เพราะเมื่อเขาทำการทดลองซ้ำโดยเปลี่ยนชนิดของโลหะที่ใช้เป็นขั้วแคโทด และเปลี่ยนชนิดของแก๊สที่บรรจุ แต่ผลการทดลองยังได้เหมือนเดิม อิเล็กตรอนเป็นองค์ประกอบร่วมที่พบในธาตุใดก็ได้ เพราะเมื่อเขาทำการทดลองซ้ำโดยเปลี่ยนชนิดของโลหะที่ใช้เป็นขั้วแคโทด และเปลี่ยนชนิดของแก๊สที่บรรจุ แต่ผลการทดลองยังได้เหมือนเดิม
 อิเล็กตรอนเป็นอนุภาคที่มีประจุลบ อิเล็กตรอนเป็นอนุภาคที่มีประจุลบ
 อัตราส่วนประจุต่อมวลของอิเล็กตรอนเท่ากับ 1.76 X 108 คูลอมบ์ต่อกรัม อัตราส่วนประจุต่อมวลของอิเล็กตรอนเท่ากับ 1.76 X 108 คูลอมบ์ต่อกรัม
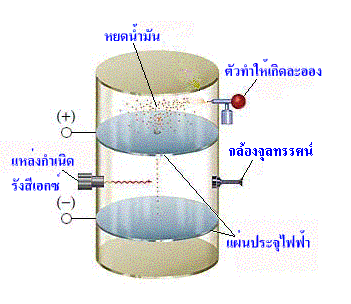
การทดลองหยดน้ำมัน(oil drop experiment)ของมิลลิแกน
รอเบิร์ต แอนดรูส์ มิลลิแกน (Millikan)
มิลลิแกน ได้ทำการทดลองเพื่อหาค่าประจุของอิเล็กตรอนโดยวิธีหยดน้ำมัน ทำได้โดย พ่นน้ำมันเป็นละอองเม็ดเล็ก ๆ ให้ตกลงมาระหว่างแผ่นโลหะ 2 แผ่น แล้วใช้รังสีเอกซ์ไปดึงอิเล็กตรอนออกจากอะตอมของแก๊สในอากาศ แล้วให้อิเล็กตรอนไปเกาะหยดน้ำมัน พบว่า แต่ละหยดน้ำมันมีอิเล็กตรอนมาเกาะจำนวนไม่เท่ากัน นั่นคือ หยดน้ำมันบางหยดมีอิเล็กตรอนเกาะติดเพียงตัวเดียว บางหยดก็มีมากกว่า 1 ตัว หยดน้ำมันจะตกลงมาตามแรงโน้มถ่วงของโลก จากนั้นให้กระแสไฟฟ้าเข้าไปในแผ่นประจุบวกและลบ แผ่นประจุลบซึ่งอยู่ด้านล่างผลักหยดน้ำมันที่มีอิเล็กตรอนมาเกาะจนหยุดนิ่ง ซึ่งดูได้ด้วยกล้องจุลทรรศน์(microscope) แสดงว่า แรงโน้มถ่วงของโลกเท่ากับแรงจากสนามไฟฟ้า แล้วคำนวณหาค่าประจุ
จากผลการทดลองมิลลิแกนคำนวณหาค่าประจุของอิเล็กตรอนได้คือ 1.60 X 10-19 คูลอมบ์ ซึ่งเป็นค่าประจุของอิเล็กตรอน 1 อิเล็กตรอน
จากการทดลองของมิลลิแกน เราทราบค่า e = 1.60 X 10-19 คูลอมบ ์
จากการทดลองของทอมสัน เราทราบค่า e/m = 1.76 X 108 คูลอมบ์/กรัม
แทนค่า 1.60 X 10-19/m = 1.76 X 108
m = 9.11 X 10-28 กรัม
ดังนั้จะทราบมวลของอิเล็กตรอนเท่ากับ 9.11 X 10-28 กรัม
| โปรตอน(proton) |
| ผู้ค้นพบ
ออยเกน โกลด์ชไตน์(Eugen Goldstein)
ทำอย่างไรจึงค้นพบ
เขาได้ศึกษาเรื่องการนำไฟฟ้าของแก๊ส
วิธีทำการทดลอง
เขาดัดแปลงหลอดรังสีแคโทด โดยเพิ่มฉากเรืองแสงที่ด้านหลังขั้วแคโทด และเจาะรู้ด้านขั้วแคโทด
เขาได้ดัดแปลงหลอดรังสีแคโทด โดยขั้วแคโทดและขั้วแอโนดอยู่ตรงกลางหลอด เพิ่มฉากเรืองแสงที่ปลายหลอดรังสีแคโทดทั้งสองด้าน
ผลการทดลอง
เมื่อบรรจุแก๊สไฮโดรเจนในหลอดรังสีแคโทด แล้วให้กระแสไฟฟ้าแก่ขั้วไฟฟ้าทั้งสอง พบว่าขั้วแคโทดจะปล่อยอิเล็กตรอนออกมา เมื่ออิเล็กตรอนชนกับอะตอมของแก๊สไฮโดรเจนจะให้โปรตอน โปรตอนซึ่งมีประจุบวกถูกดึงดูดโดยขั้วแคโทดซึ่งมีประจุลบไปตกกระทบยังฉากเรืองแสง ปริมาณอิเล็กตรอนในหลอดรังสีแคโทดมีมากมาย ทำให้มีโปรตอนไปตกกระทบที่ฉากเรืองแสงมากมาย จนเราสังเกตเห็นเป็นลำแสงพุ่งตรงไปยังฉากหลังขั้วแคโทด
สรุปผลการทดลอง
อนุภาคที่ถูกดึงดูดโดยขั้วไฟฟ้าที่เป็นลบ ต้องเป็นอนุภาคที่มีประจุบวก ต่อมานักวิทยาศาสตร์เรียกว่า"โปรตอน " เนื่องจากถูกดึงดูดโดยขั้วแคโทดซึ่งเป็นขั้วลบ และโดนแรงผลักจากขั้วแอโนดซึ่งเป็นขั้วบวก
นิวตรอนเป็นอนุภาคที่ถูกค้นพบช้าที่สุด ทำไมจึงเป็นเช่นนั้น
 นิวตรอน(neutron) นิวตรอน(neutron) |
| ผู้ค้นพบ
เจมส์ แชดวิก(James Chadwick)
ทำอย่างไรจึงค้นพบ
เขาได้พิจารณาจากแบบจำลองของรัทเทอร์ฟอร์ด จะพบว่ามวลรวมของอะตอมน่าจะมีค่าเท่ากับมวลรวมของโปรตอนได้เลย เพราะว่าอิเล็กตรอนมีมวลน้อยมาก แต่จากการพิจารณามวลอะตอมของธาตุบางธาตุกลับมีมวลเป็นสองเท่าหรือมากกว่าสองเท่า เช่น ฮีเลียมมี 2 โปรตอนและ 2 อิเล็กตรอน น่าจะมีมวลอะตอม 2 หน่วย แต่กลับมี 4 หน่วย เขาจึงคิดว่าน่าจะมีอนุภาคอื่นนอกจากโปรตอนและอิเล็กตรอนในอะตอม ซึ่งอนุภาคนี้ทำให้มวลอะตอมเพิ่มขึ้น
วิธีทำการทดลอง
เขาระดมยิงเบริลเลียม(Be)ด้วยอนุภาคแอลฟา(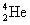 ) ซึ่งได้จากธาตุพอโลเนียม(Po) ) ซึ่งได้จากธาตุพอโลเนียม(Po)
จากนั้น ทดลองซ้ำโดยเปลี่ยนเบริลเลียมเป็นธาตุอื่น เช่น โบรอน(B), ไนโตรเจน(N), ออกซิเจน(O), อาร์กอน(Ar) ฯลฯ
ผลการทดลอง
จากการทดลองพบว่า เมื่อระดมยิงเบริลเลียม(Be)ด้วยอนุภาคแอลฟา(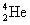 )จะตรวจพบ )จะตรวจพบ 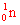 ดังสมการ ดังสมการ
นอกจากนั้น เขายังทำการทดลองกับโบรอน(B)
และ เขายังทำการทดลองกับไนโตรเจน(N), ออกซิเจน(O), อาร์กอน(Ar) ฯลฯ ทุกครั้งที่เขาทำการทดลอง เขาจะตรวจพบ 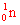 ทุกครั้ง ทุกครั้ง
สรุปผลการทดลอง
เขาพบอนุภาคใหม่คือ 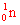 เขาให้ชื่ออนุภาคนี้ว่า "นิวตรอน" ซึ่งมีมวลใกล้เคียงโปรตอนและเป็นกลางทางไฟฟ้า ด้วยคุณสมบัติของนิวตรอนคือเป็นกลางทางไฟฟ้า จึงไม่เบี่ยงเบนในหลอดรังสีแคโทดทำให้นักวิทยาศาสตร์ค้นพบอนุภาคนี้ช้าที่สุด เขาให้ชื่ออนุภาคนี้ว่า "นิวตรอน" ซึ่งมีมวลใกล้เคียงโปรตอนและเป็นกลางทางไฟฟ้า ด้วยคุณสมบัติของนิวตรอนคือเป็นกลางทางไฟฟ้า จึงไม่เบี่ยงเบนในหลอดรังสีแคโทดทำให้นักวิทยาศาสตร์ค้นพบอนุภาคนี้ช้าที่สุด
การค้นพบนิวตรอนทำให้โครงสร้างอะตอมของดาลตัน, ทอมสันและรัทเทอร์ฟอร์ดไม่ถูกต้อง เพราะไม่มีนิวตรอนในโครงสร้างอะตอม จึงเกิดการเปลี่ยนแปลงแนวความคิดของนักวิทยาศาสตร์ในเรื่องโครงสร้างอะตอม หลังจากนั้นจึงเกิดโครงสร้างอะตอมของโบร์ขึ้นมาแทนที่โครงสร้างอะตอมแบบเดิม ๆ
ไอโซโทป
เมื่อพิจารณาอนุกรมการสลายของธาตุกัมมันตรังสีจะพบว่า มีนิวเคลียสบางกลุ่มซึ่งทุกนิวเคลียสมีเลขอะตอมมเท่ากัน แต่มีเลขมวลต่างกัน เช่น กลุ่มของยูเรเนียม ซึ่งมียูเรเนียม -234 ยูเรเนียม -235 และยูเรเนียม -238 นิวเคลียสในกลุ่มนี้ต่างมีเลขอะตอมเท่ากันคือ 92 แต่มีจำนวนนิวตรอนในนิวเคลียสต่างกัน เราเรียกนิวเคลียสที่มีจำนวนโปรตอนเท่ากัน แต่มีจำนวนนิวตรอนต่างกันนี้ว่าเป็น ไอโซโทปของธาตุเดียวกัน
ไอโซโทปของธาตุอาจมีชนิดที่ไม่เสถียรซึ่งเรียกว่า ไอโซโทปกัมมันตรังสี และชนิดที่ไม่มีการสลายต่อไปซึ่งเรียกว่า ไอโซโทปเสถียร เช่น ไอโซโทปของตะกั่วมี 5 ชนิด ซึ่งเป็นไอโซโทปกัมมันตรังสี 2 ชนิด คือตะกั่ว -210 และตะกั่ว -214 สำหรับธาตุบางธาตุอาจมีแต่ไอโซโทปกัมมันตรังสีเท่านั้น
เนื่องจากไอโซโทปของธาตุเดียวกันมีเลขอะตอมเท่ากัน แต่เลขมวลต่างกัน จึงมีสมบัติทางเคมีเหมือนกันแต่สมบัติทางกายภาพต่างกน ดังนั้นการวิเคราะห์ไอโซโทปของธาตุชนิดหนึ่งจึงไม่สามารถกระทำได้โดยอาศัยปฏิกิริยาเคมี แต่ด้วยเหตุที่ไอโซโทปมีสมบัติทางกายภาพต่างกันเช่น มีมวลต่างกัน การวิเคราะห์ไอโซโทปจึงสามารถกระทำได้โดยจำแนกมวลของไอโซโทปมวลของไอโซโทปของธาตุชนิดเดียวกันมีความแตกต่างกันน้อยมาก การวิเคราะห์ไอโซโทปจึงต้องใช้เครื่องมือที่สามารถวัดมวลได้ละเอียดมาก เครื่องมือประเภทนี้ได้แก่ แมสสเปกโทรมิเตอร์ (mass spectrometer) ดังจะได้ศึกษารายละเอียดในการหาค่ามวลดังต่อไปนี้
รูป 20.10 ส่วนประกอบที่สำคัญของแมสสเปกโทรมิเตอร์
แมสสเปกโทรมิเตอร์เป็นเครื่องมือที่ใช้วิเคราะห์มวลอะตอมของธาตุต่างๆ โดยอาศัยหลักการเคลื่อนที่ของอนุภาคที่มีประจุไฟฟ้าในสนามแม่เหล็กและสนามไฟฟ้า ส่วนประกอบที่สำคัญของแมสสเปกโทรมิเตอร์ คือ ส่วนเร่งอนุภาค ส่วนคัดเลือกความเร็วและส่วนวิเคราะห์ ดังรูป 20.10 ส่วนเร่งอนุภาคมีหน้าที่ทำให้ไอโซโทปที่เป็นแก๊สกลายสภาพเป็นอนุภาคที่มีประจุไฟฟ้า จากนั้นอนุภาคนี้จะถูกเร่งให้พุ่งผ่านช่องที่ทำไว้และเข้าไปยังส่วนคัดเลือกความเร็ว ซึ่งประกอบด้วยบริเวณที่มีสนามไฟฟ้า  และสนามแม่เหล็ก และสนามแม่เหล็ก ซึ่งมีทิศตั้งฉากกันและตั้งฉากกับทิศการเคลื่อนที่ของอนุภาคที่ผ่านเข้ามา ดังรูป 20.11 ดังนั้นแรงที่กระทำต่อนุภาคอันเนื่องจากสนามทั้งสองจึงมีทิศทางตรงข้ามกัน ซึ่งมีทิศตั้งฉากกันและตั้งฉากกับทิศการเคลื่อนที่ของอนุภาคที่ผ่านเข้ามา ดังรูป 20.11 ดังนั้นแรงที่กระทำต่อนุภาคอันเนื่องจากสนามทั้งสองจึงมีทิศทางตรงข้ามกัน
รูป 20.11 หลักการทำงานของส่วนคัดเลือกความเร็ว
ถ้าอนุภาคมีความเร็วพอเหมาะขนาดของแรงอันเนื่องมากจากสนามทั้งสองจะมีค่าเท่ากันจึงทำให้เกิดสมดุลของแรง มีผลให้อนุภาคเคลื่อนที่ต่อไปโดยไม่เปลี่ยนแนวการเคลื่อนที่ และสามารถพุ่งตรงไปผ่านช่องอีกช่องหนึ่งที่ทำไว้ได้ ส่วนอนุภาคที่มีความเร็วแตกต่างไปจากค่าที่พอเหมาะจะมีแนวการเคลื่อนที่จะเบี่ยงเบน ทำให้ไม่สามารถทะลุผ่านช่องที่สองไปได้
ถ้าให้อนุภาคที่เคลื่อนที่ผ่านช่องที่หนึ่งเข้ามาในบริเวณที่มีสนามไฟฟ้า  และสนามแม่เหล็ก และสนามแม่เหล็ก  มีอัตราเร็วเท่ากับ v และประจุไฟฟ้าของอนุภาคนั้นเป็น q เมื่อเกิดสมดุลจะได้ว่า มีอัตราเร็วเท่ากับ v และประจุไฟฟ้าของอนุภาคนั้นเป็น q เมื่อเกิดสมดุลจะได้ว่า
qvB = qE
หรือ 
จะเห็นได้ว่าสามารถหาอัตราเร็ว v ได้จากอัตราส่วนของขนาดสนามไฟฟ้าและขนาดสนามแม่เหล็กในบริเวณส่วนคัดเลือกความเร็วดังนั้นกลุ่มอนุภาคที่มีอัตราเร็วดังกล่าวนี้จะเคลื่อนที่เข้าสู่ส่วนวิเคราะห์ซึ่งมีสนามแม่เหล็ก  ที่มีทิศตั้งฉากกับแนวการเคลื่อนที่ของอนุภาคทำให้เกิดแรงเนื่องจากสนามแม่เหล็กนี้บังคับให้อนุภาคที่มีมวลต่างกันเคลื่อนที่เป็นแนวโค้งรูปวงกลม ดังรูป 20.12 ที่มีทิศตั้งฉากกับแนวการเคลื่อนที่ของอนุภาคทำให้เกิดแรงเนื่องจากสนามแม่เหล็กนี้บังคับให้อนุภาคที่มีมวลต่างกันเคลื่อนที่เป็นแนวโค้งรูปวงกลม ดังรูป 20.12
รูป 20.12 ส่วนวิเคราะห์ที่มีสนามแม่เหล็ก 
ตั้งฉากกับทิศทางการเคลื่อนที่ของอนุภาคที่มีประจุ
เพราะอนุภาคที่มีมวลต่างกันเคลื่อนที่เป็นแนวโค้งรูปวงกลมที่มีรัศมีต่างกัน ดังนั้นเมื่ออนุภาคเหล่านั้นกระทบแผ่นฟิล์มจะทำให้เกิดรอยดำ ถ้า R เป็นรัศมีความโค้งของวงกลม และ m เป็นมวลของอนุภาคและ B เป็นสนามแม่เหล็กในบริเวณนี้ จะได้ว่า เป็นสนามแม่เหล็กในบริเวณนี้ จะได้ว่า
 (20.7) (20.7)
สมการ (20.7) แสดงว่า มวลของอนุภาคแปรผันตรงกับรัศมีความโค้ง และเนื่องจากมวลของแต่ละไอโซโทปแตกต่าง
กัน ดังนั้นรัศมีความโค้งของแต่ละไอโซโทปจะแตกต่างกัน การวัดรัศมีจึงเป็นหลักการที่เครื่องมือนี้วิเคราะห์ไอโซโทปได้
ในการวิเคราะห์ผลค่า E, B, B , R เป็นค่าที่รู้จากการทดลอง และ q คือประจุไฟฟ้าของอนุภาคดังนั้นเราจึงสามารถหาค่ามวล m ได้ วิธีการนี้ทำให้เราสามารถหาค่ามวลอะตอมของธาตุต่างๆ ได้ค่ามวลอะตอมของไอโซโทปบางชนิดแสดงไว้ในตาราง 20.3 , R เป็นค่าที่รู้จากการทดลอง และ q คือประจุไฟฟ้าของอนุภาคดังนั้นเราจึงสามารถหาค่ามวล m ได้ วิธีการนี้ทำให้เราสามารถหาค่ามวลอะตอมของธาตุต่างๆ ได้ค่ามวลอะตอมของไอโซโทปบางชนิดแสดงไว้ในตาราง 20.3
ตาราง 20.3 แสดงค่ามวลอะตอมของธาตุบางธาตุ
ธาตุ
|
เลขอะตอม
|
เลขมวล
|
มวลอะตอม (u)
|
ปริมาณในธรรมชาติ (%)
|
ไฮโดรเจน
|
1
|
1
|
1.007825
|
99.98
|
|
1
|
2
|
2.014102
|
0.02
|
|
1
|
3
|
3.016049
|
-
|
ฮีเลียม
|
2
|
3
|
3.016029
|
|
|
2
|
4
|
4.002604
|
|
|
2
|
5
|
5.012297
|
-
|
|
2
|
6
|
6.018893
|
-
|
ลิเทียม
|
3
|
5
|
5.012538
|
-
|
|
3
|
6
|
6.015126
|
7.4
|
|
3
|
7
|
7.016005
|
92.6
|
|
3
|
8
|
8.022487
|
-
|
เบริลเลียม
|
4
|
7
|
7.016929
|
-
|
|
4
|
8
|
8.005308
|
-
|
|
4
|
9
|
9.012186
|
100
|
|
4
|
10
|
10.013534
|
-
|
คาร์บอน
|
6
|
10
|
10.016810
|
-
|
|
6
|
11
|
11.011432
|
-
|
|
6
|
12
|
12.000000
|
98.9
|
|
6
|
13
|
13.003354
|
1.1
|
|
6
|
14
|
14.003242
|
-
|
ไนโตรเจน
|
7
|
12
|
12.018641
|
-
|
|
7
|
13
|
13.005738
|
-
|
|
7
|
14
|
14.003074
|
99.635
|
|
7
|
15
|
15.000108
|
0.365
|
|
7
|
16
|
16.006103
|
-
|
|
7
|
17
|
17.008450
|
-
|
ออกซิเจน
|
8
|
14
|
14.008597
|
-
|
|
8
|
15
|
15.003070
|
-
|
|
8
|
16
|
15.994915
|
99.759
|
|
8
|
17
|
16.999134
|
0.037
|
|
8
|
18
|
17.999160
|
0.204
|
|
8
|
21
|
21.008730
|
-
|
ทองคำขาว
|
78
|
191
|
190.961665
|
|
|
78
|
192
|
191.961019
|
0.79
|
|
78
|
193
|
192.962977
|
-
|
|
78
|
194
|
193.962655
|
32.9
|
|
78
|
195
|
194.964766
|
33.8
|
|
78
|
196
|
195.964926
|
23.3
|
ทองคำ
|
79
|
197
|
196.966543
|
100.00
|
ตะกั่ว
|
82
|
204
|
203.973020
|
1.4
|
|
82
|
206
|
205.974440
|
24.1
|
|
82
|
207
|
206.97582
|
22.1
|
|
82
|
208
|
207.976627
|
52.4
|
ทอเรียม
|
90
|
232
|
232.038054
|
100.00
|
|
90
|
234
|
234.043953
|
|
|
90
|
235
|
235.047510
|
|
หมายเหตุ ธาตุที่ไม่ได้ระบุปริมาณในธรรมชาติเป็นธาตุกัมมันตรังสี
|
|
|
 อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"
อะตอมที่เป็นกลางทางไฟฟ้าจะมีประจุบวกเท่ากับประจุลบ แสดงว่าในอะตอมมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอนซึ่งในอะตอมจะมีโปรตอนจำนวนเท่ากับ "เลขอะตอม"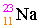




(5).jpg)
 และสนามแม่เหล็ก
และสนามแม่เหล็ก
(6).jpg)
 และสนามแม่เหล็ก
และสนามแม่เหล็ก  มีอัตราเร็วเท่ากับ v และประจุไฟฟ้าของอนุภาคนั้นเป็น q เมื่อเกิดสมดุลจะได้ว่า
มีอัตราเร็วเท่ากับ v และประจุไฟฟ้าของอนุภาคนั้นเป็น q เมื่อเกิดสมดุลจะได้ว่า
 ที่มีทิศตั้งฉากกับแนวการ
ที่มีทิศตั้งฉากกับแนวการ(6).jpg)








ไม่มีความคิดเห็น:
แสดงความคิดเห็น